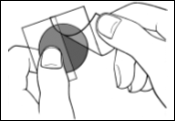
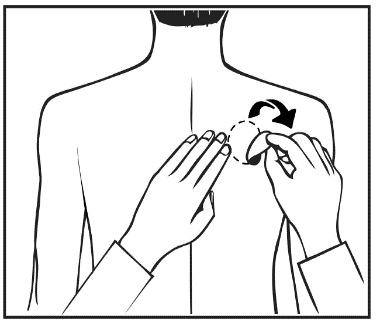
Turvallisuustiedote terveydenhuollon ammattilaisille Exelon®- depotlaastarien epäasianmukaisesta käytöstä ja lääkitysvirh

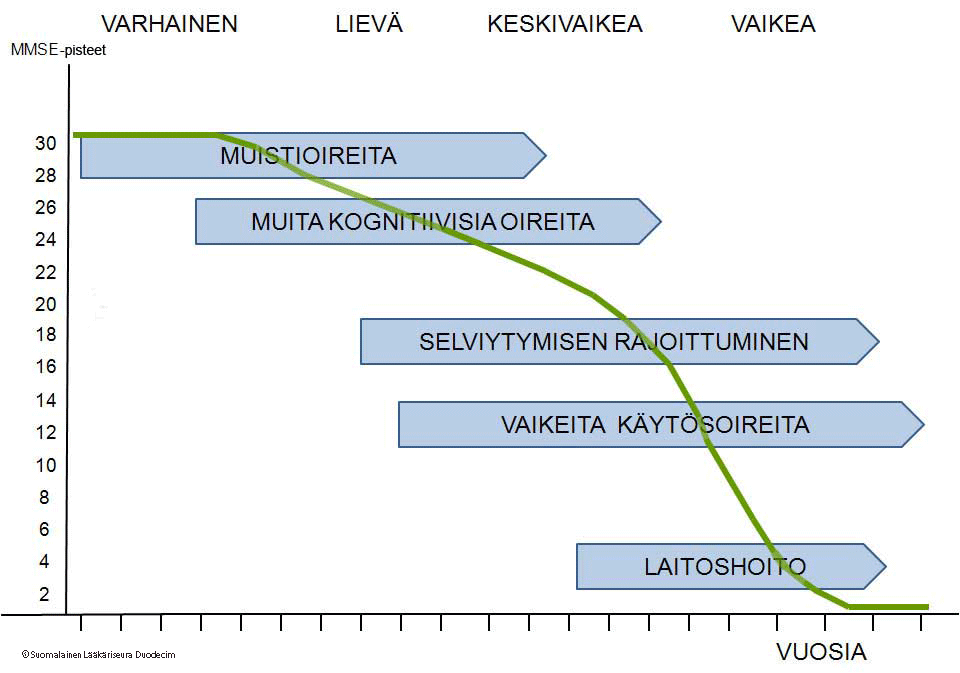
Alzheimerin taudin (ja muiden muistisairauksien) diagnostiikan, ennaltaehkäisyn ja hoidon mahdollisuudet Raimo Sulkava, professori neurologian ja geriatrian. - ppt lataa
Lääkeinfo.fi - lääkevalmisteiden pakkausselosteet - EXELON depotlaastari 4,6 mg/24 h, 9,5 mg/24 h, 13,3 mg/24 h
LÄÄKEMUOTOIHIN LIITTYVÄT ONGELMAT PALVELUASUMISEN YKSIKÖISSÄ ASUVIEN IÄKKÄIDEN LÄÄKEHOIDOSSA Johanna Niittymäki Helsin
FOLLETO DE INFORMACIÓN AL PACIENTE RIVAZIC PARCHES RIVASTIGMINA Liberación: 4,6 mg/24 h – 9,5 mg/24 h – 13,3 mg/24 h Siste
Turvallisuustiedote terveydenhuollon ammattilaisille Exelon®- depotlaastarien epäasianmukaisesta käytöstä ja lääkitysvirh
IKÄÄNTYNEEN MUISTISAIRAAN TOIMINTAKYVYN TUNNIS- TAMISEEN LIITTYVÄ OSAAMINEN KOTIHOIDON HOITAJIEN ARVIOIMANA